Xp11.2易位性肾细胞癌(Xp11.2 tRCC)是2016 WHO分型中RCC的一个独立亚群,其特点是转录因子E3 (TFE3)融合基因高表达导致患者预后不良[1]。越来越多的研究表明,这些高表达的TFE3融合蛋白可以通过直接或间接调控下游靶基因,作为癌症的主要驱动因子。
环状RNA(circRNAs)是一类功能性非编码RNA (ncRNAs),具有由前体mRNA剪接或跳过事件形成的环状结构,不存在5'末端帽子和3'末端poly(A)尾巴[2]。由于环状结构,环状RNA对外切酶具有抗性,因此它们的半衰期比线性RNA更长。越来越多的证据表明,环状RNA在癌症的发生和进展中发挥了重要作用[3]。然而环状RNA与tRCC肿瘤发生相关潜在的分子机制尚不清楚。
近期,南京大学医学院李冬梅/甘卫东团队在Molecular Cancer杂志上发表题为CircMET promotes tumor proliferation by enhancing CDKN2A mRNA decay and upregulating SMAD3的研究论文,详细阐述了circMET在肿瘤中调控细胞增殖的功能及机制[4]。

01 CircMET在NONO-TFE3 tRCC中显著高表达
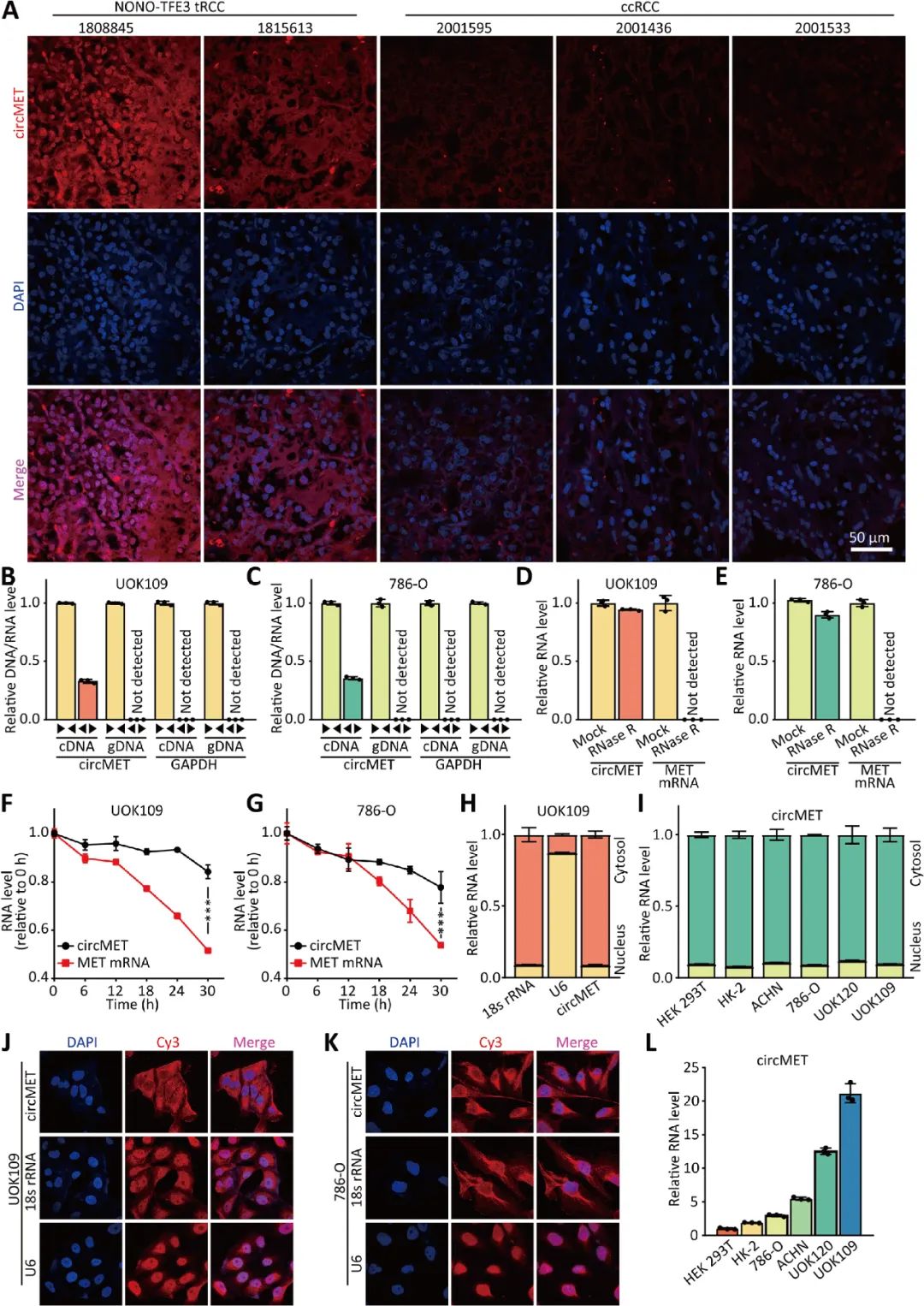
02 CircMET促进NONO-TFE3 tRCC的增殖
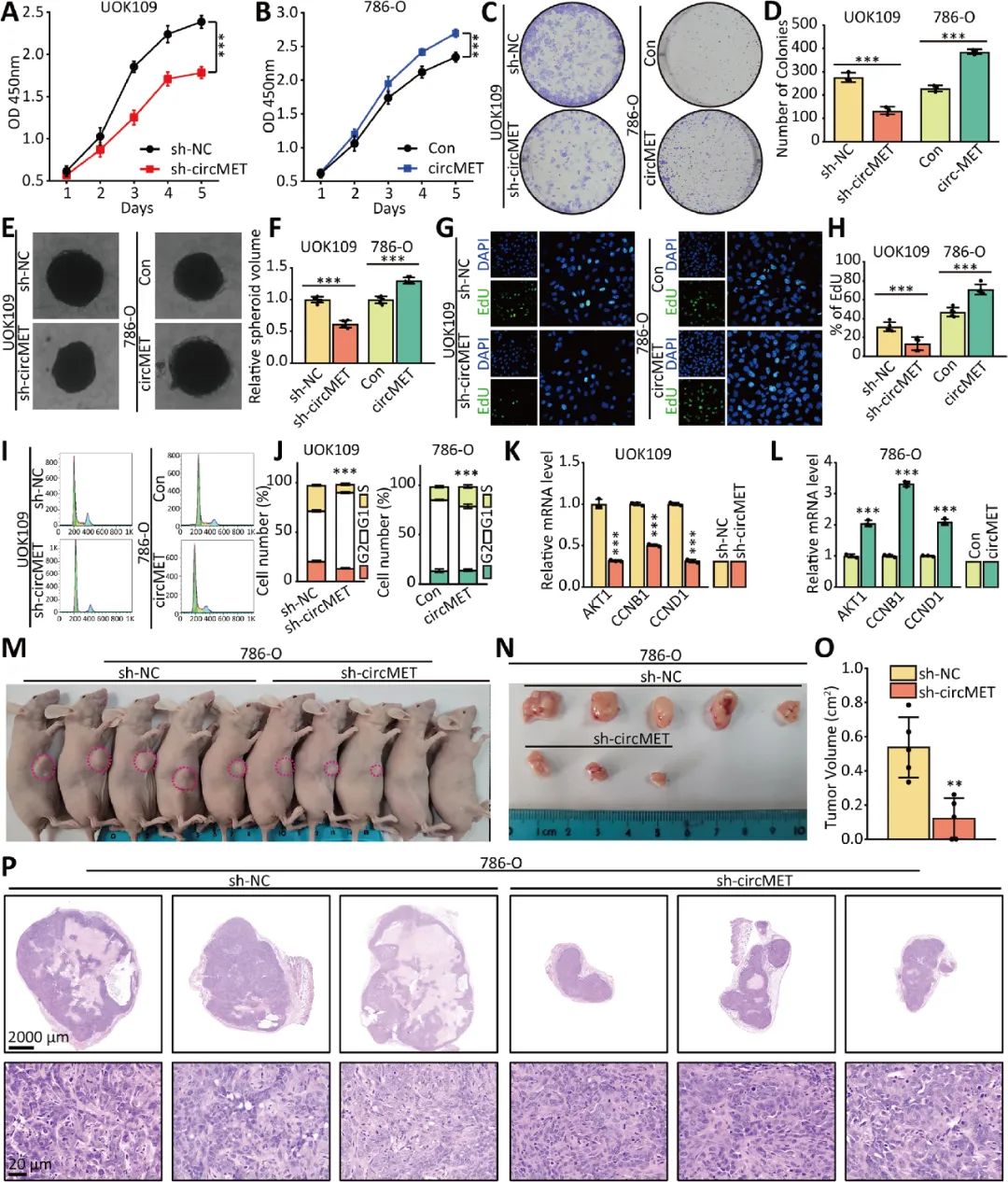
为了确定circMET在NONO-TFE3 tRCC的生物学行为中的功能作用,作者研究了上调或下调circMET对癌细胞生长的影响。体外细胞和体内成瘤实验结果表明circMET促进NONO-TFE3 tRCC的增殖(图2)。
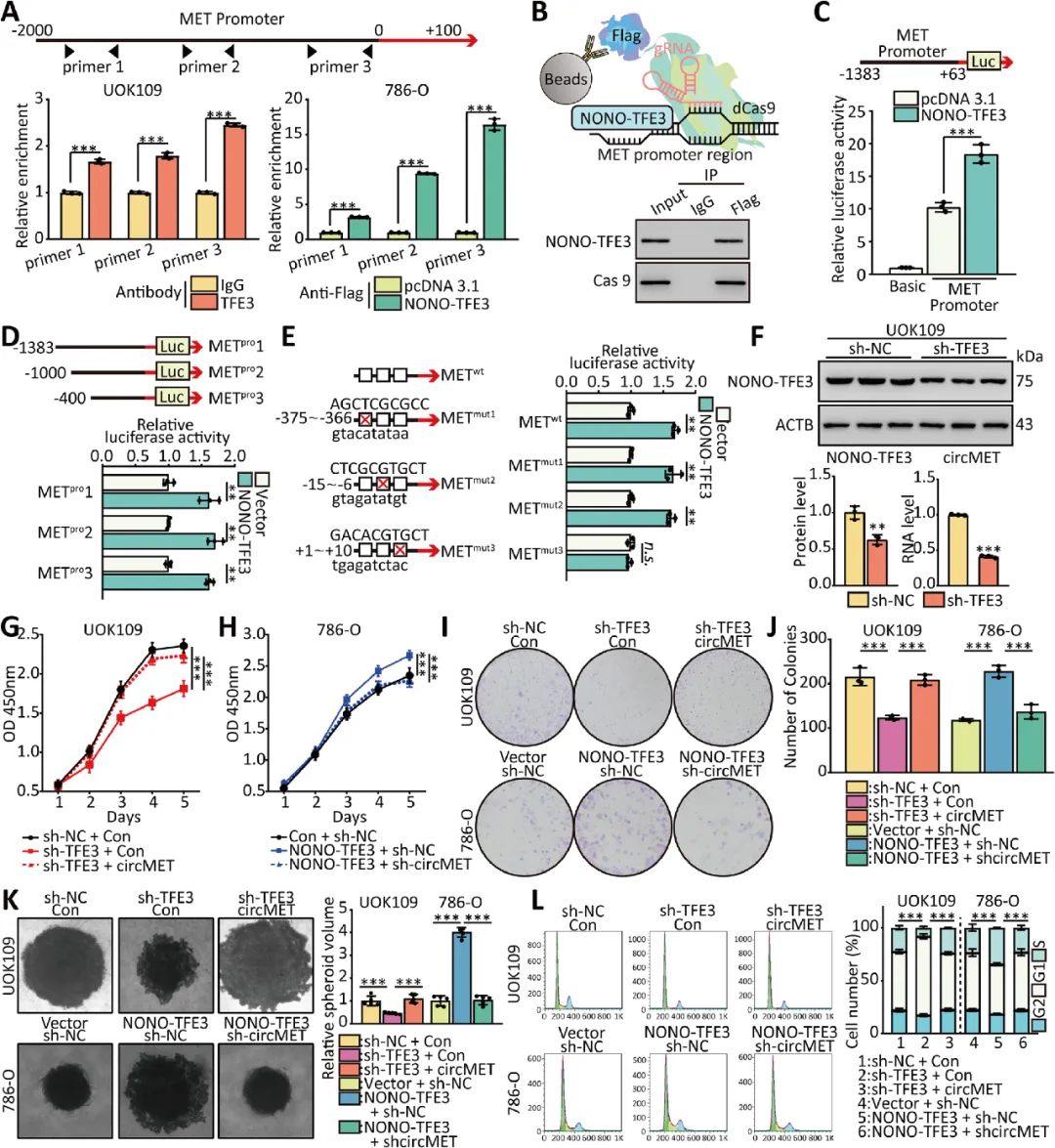
03 NONO-TFE3增强了circMET的转录
研究人员通过体外功能缺失和功能获得改变NONO-TFE3蛋白水平,并分别检测UOK109和786-O细胞中circMET的表达。双萤光素酶酶实验等表明NONO-TFE3通过上调circMET的表达促进NONO-TFE3 tRCC的进展(图3)。
04 CircMET通过YTHDC1以m6A依赖的方式输出到细胞质中
YTHDC1作为m6A解读器蛋白的一员,已知参与RNA剪接和RNA核输出,研究团队进一步通过CRISPR/dCas13构建的靶向去修饰系统证实,YTHDC1可通过m6A依赖性的方式促进circMET出核并发挥功能(图4)。

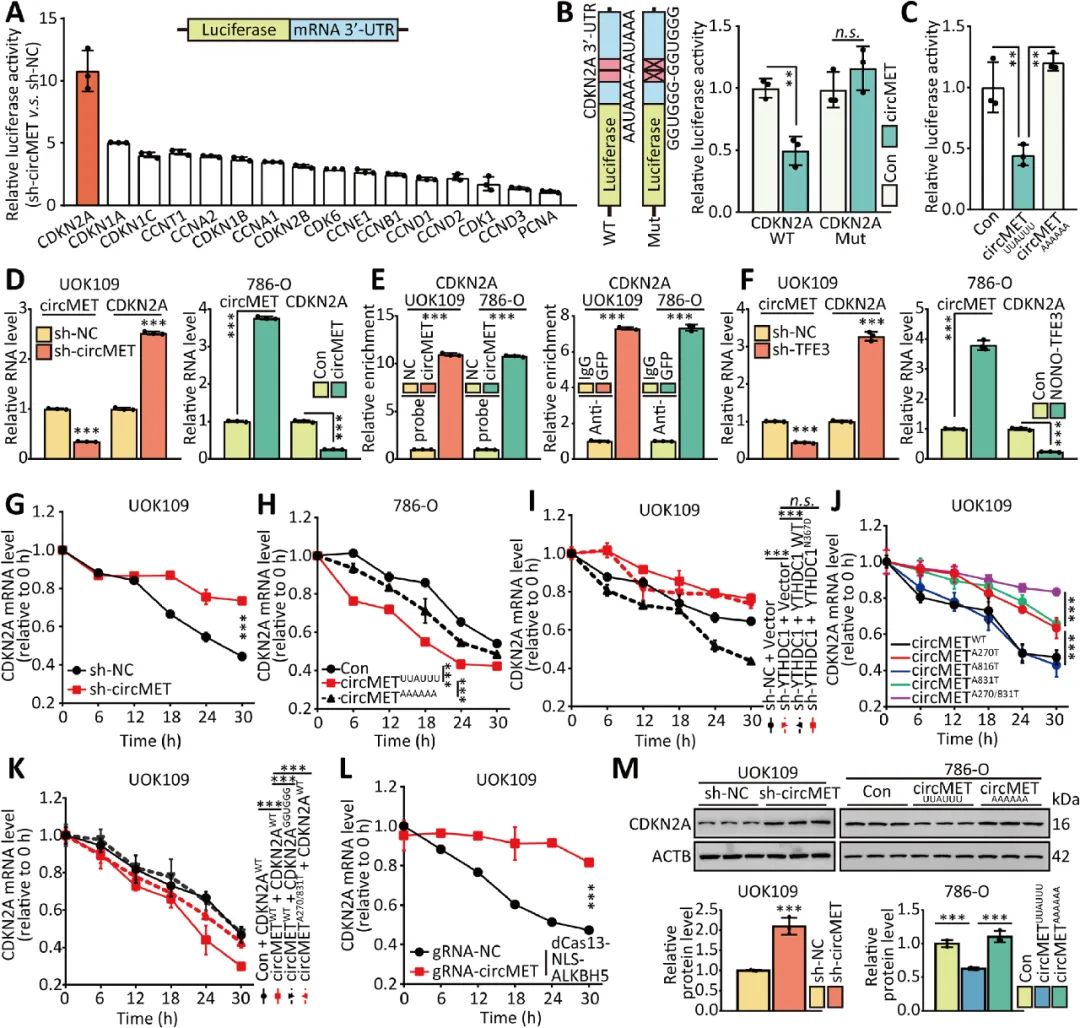
05 CircMET通过直接结合下调CDKN2A mRNA
circMET已被证实能促进NONO-TFE3 tRCC的增殖,作者进一步研究circMET是否能调控与细胞周期相关的基因表达,沉默circMET后萤光素酶活性上调最明显的是CDKN2A。CDKN2A是一种肿瘤抑制基因,编码p16蛋白,抑制细胞周期。实验证实circMET通过直接结合下调CDKN2A mRNA的稳定性来促进肿瘤的生长(图5)。
06 CircMET通过招募YTHDF2来加速CDKN2A mRNA的衰减
研究人员进一步证实circMET通过与CDKN2A mRNA 3’UTR直接结合,并且募集m6A阅读蛋白YTHDF2调控CDKN2A mRNA的降解。circMET募集YTHDF2至CDKN2A mRNA的过程中,YTHDF2直接结合在circMET的m6A修饰位点,并参与CDKN2A mRNA的降解过程,而YTHDF2并未直接结合CDKN2A mRNA上的m6A修饰位点(图6)。
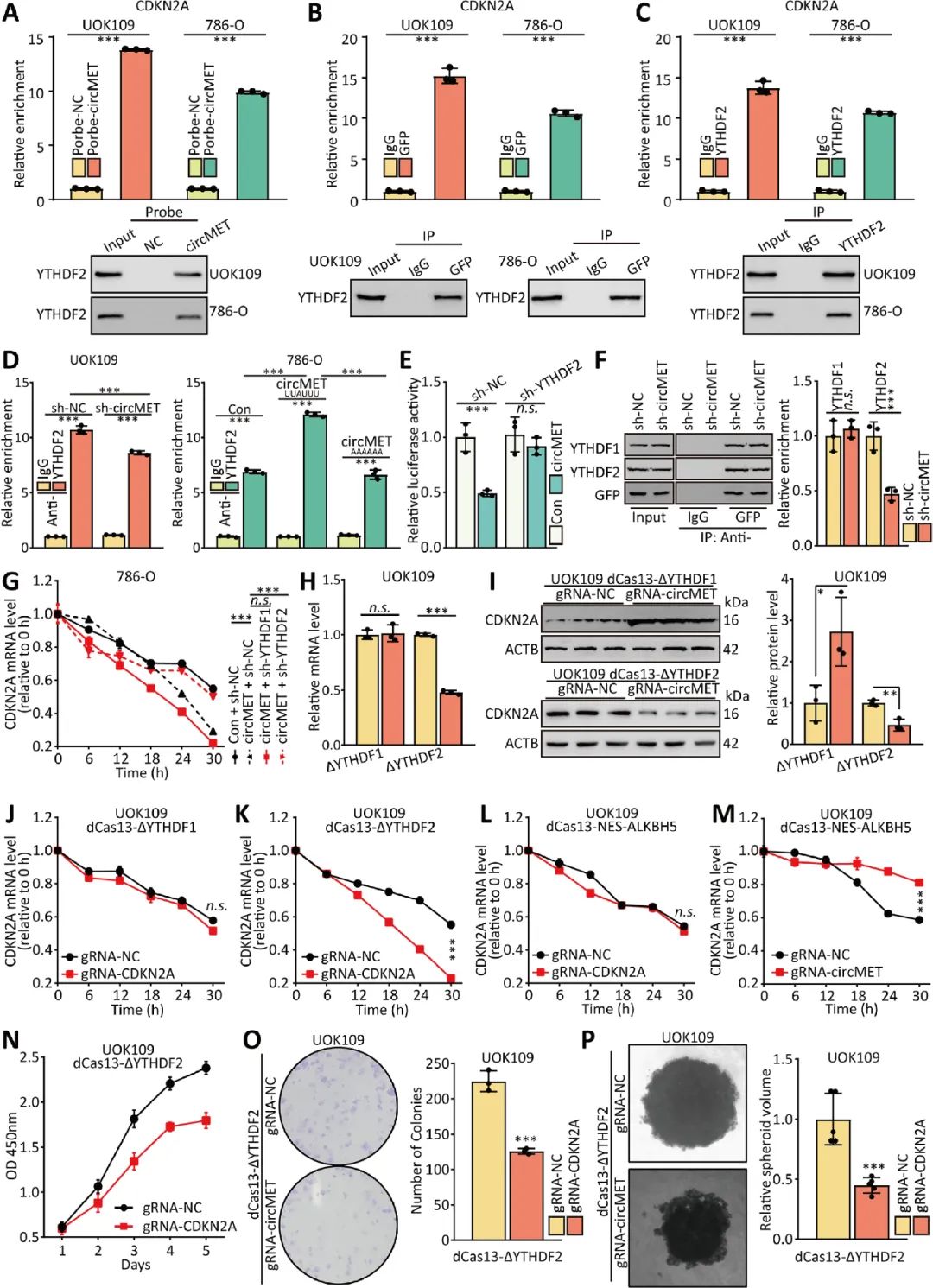
07 CircMET作为ceRNA来海绵吸收miRNAs
大量研究证实,环状RNA作为mirRNA的生物海绵,在调控基因表达中发挥重要作用。circMET在细胞内的分布提示circMET可能也具有转录后调控功能,有助于NONO-TFE3 tRCC的增殖。通过软件预测和萤光素酶等实验证实miR-1197是circMET潜在的miRNA靶点,细胞水平验证circMET作为ceRNA对miR-1197具有海绵吸附作用(图7)。
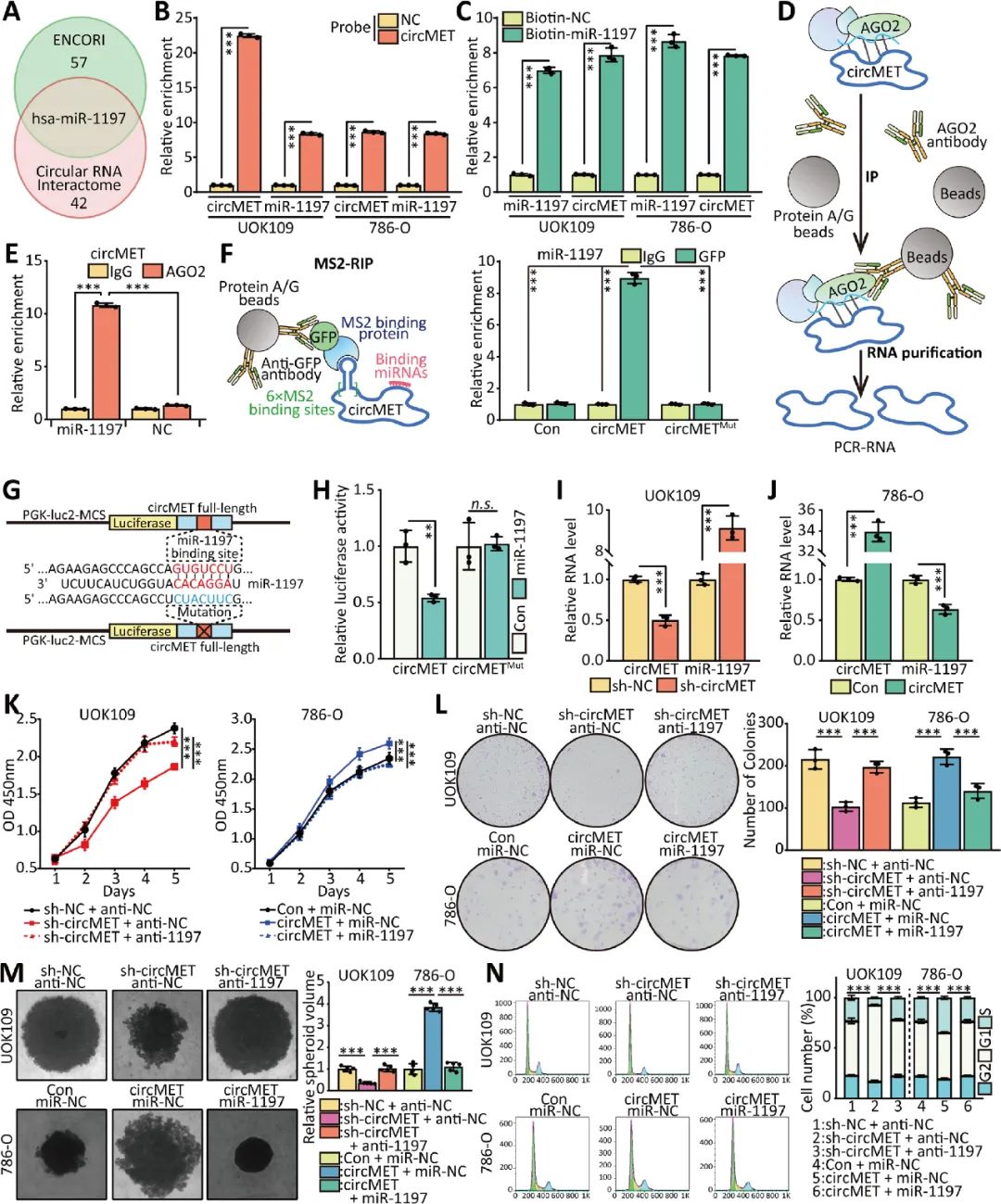
08 CircMET通过转录后调控SMAD3的表达
双萤光素酶检测结果显示,过表达miR-1197后,萤光素酶活性下调最明显的是SMAD3, miR-1197可以结合SMAD3 mRNA的3’UTR,并介导NONO-TFE3 tRCC中SMAD3的表达水平。circMET可以通过充当miRNAs的“吸附剂”,通过转录后调控SMAD3的表达(图8)。
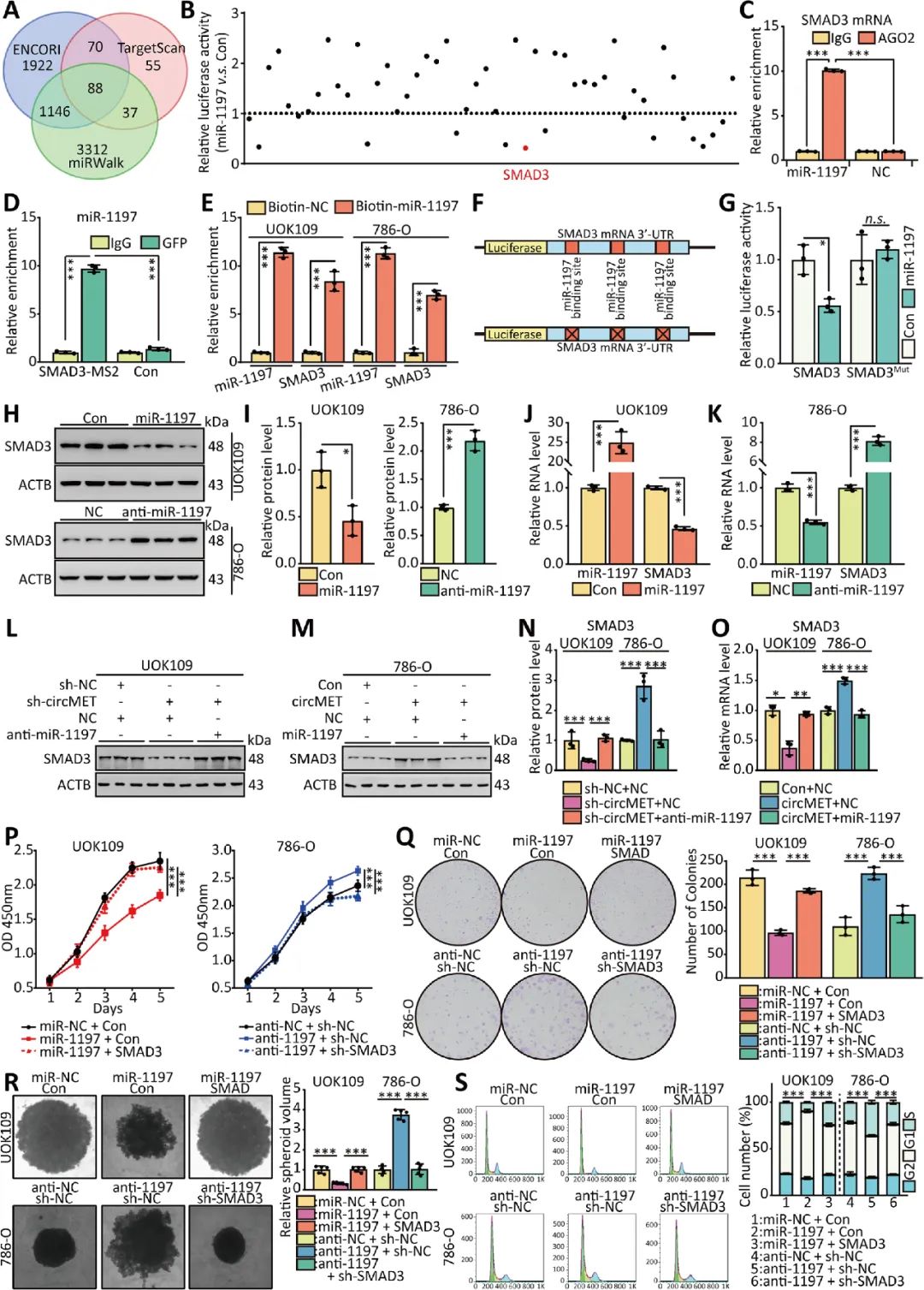
本文研究发现NONO-TFE3融合可上调NONO-TFE3 tRCC组织和细胞中circMET的表达,过表达circMET可显著促进NONO-TFE3 tRCC的生长。YTHDC1通过与m6A修饰结合,促进circMET的胞质输出。circMET不仅可以通过充当miRNAs的“吸附剂”调控SMAD3的表达,还可以通过直接与mRNA结合调控CDKN2A mRNA的稳定性(图9)。CircMET有可能成为NONO-TFE3 tRCC以及其他高表达CircMET的癌症分子治疗的新靶点。
和元生物有幸为本研究提供慢病毒载体构建和病毒包装服务,用实际行动助力肿瘤研究!
参考文献:
[1] Moch H, Cubilla AL, Humphrey PA, Reuter VE, Ulbright TM. The 2016 WHO Classification of Tumours of the Urinary System and Male Genital Organs Part A: Renal, Penile, and Testicular Tumours. Eur Urol. 2016;70:93–105. [2] Goodall GJ, Wickramasinghe VO. RNA in cancer. Nat Rev Cancer.2021;21:22–36
[3] Chen L, Shan G. CircRNA in cancer: Fundamental mechanism and clinicalpotential. Cancer Lett. 2021;505:49–57.
[4] Lei Yang, Yi Chen., et al. CircMET promotes tumor proliferation by enhancing CDKN2A mRNA decay and upregulating SMAD3. Mol Cancer.2022 Jan 18;21(1):23.doi: 10.1186/s12943-022-01497-w.
