众所周知,脂肪酸代谢通过增强脂质合成、储存和分解代谢来维持肿瘤发生、进展以及治疗抵抗。最近,膜脂肪酸组成(如饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸比例)在促进细胞存活以及脂毒性限制和铁死亡等方面的作用越来越受到重视。除此之外,现在研究已明确,肿瘤细胞在脂肪酸代谢方面表现出可塑性,对瘤外和全身代谢信号(如肥胖和肿瘤治疗)作出反应,以促进侵略性、治疗抵抗相关疾病发展。本研究阐述了与治疗抵抗相关的细胞脂肪酸代谢变化,以及肥胖相关宿主脂肪酸代谢变化影响局部肿瘤微环境进而改变癌细胞行为,同时出现潜在的新的代谢脆弱性。

一、脂肪酸代谢途径
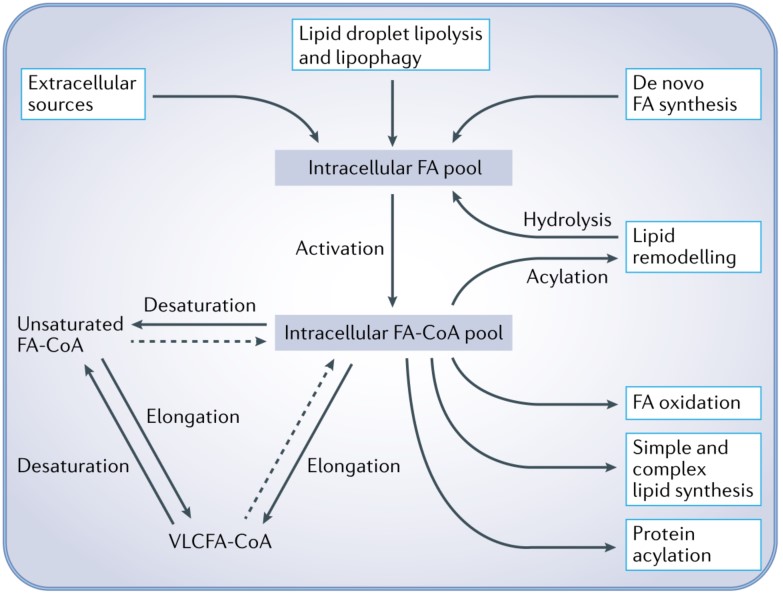
脂肪酸代谢以多种方式影响癌细胞生物学,特别是膜脂质合成,甘油磷脂和信号中间体,如4,5-二磷酸磷脂酰肌醇、二酰基甘油(DAG)和磷脂均可促进有丝分裂和/或致癌信号。细胞脂肪酸代谢包括多种代谢途径。癌细胞可以从细胞外获得FAs,包括通过内吞溶酶体处理的脂蛋白(如乳糜微粒、VLDL和LDL)、游离FAs和通过巨胞饮作用获得的FAs,这些都是细胞内FA池的关键输入。细胞内FAs来源包括从头合成FA、脂滴脂解和脂吞噬、甘油磷脂水解。从头合成FA是通过乙酰辅酶A羧化酶和脂肪酸合酶催化,利用非脂质底物如胞外乙酸盐、葡萄糖和氨基酸(包括谷氨酰胺)合成棕榈酸酯。脂解和脂吞噬则动员以甘油三酯形式储存在脂滴中的FAs。而脂滴吞噬的分子调控尚不清楚。
FAs通过长链酰基辅酶A合成酶转化为脂肪酸酰基辅酶A而被激活从而成为一系列反应底物。脂酰辅酶A可以通过硬脂酰辅酶A或delta-5 (FADS1)和delta-6 (FADS2) FA等去饱和酶作用去饱和或通过超长链FA (VLCFA)酶的作用伸长,从而生成单不饱或多不饱和FAs,用于合成更复杂的脂类(包括膜甘油磷脂)。
FA-CoA可以通过线粒体和过氧化物酶体氧化作用被分解为细胞提供能量。VLCFA-CoA通过过氧化物酶体β-氧化处理产生乙酰肉碱和较短的酰基肉碱,它们是线粒体氧化的底物。长链FA(LCFA)- CoAs通过肉碱棕榈酰转移酶(CPT)体系进入线粒体,CPT由CPT1(肉碱-酰基肉碱转移酶)和CPT2组成,而短链和中链FA-CoAs通过被动扩散进入。饱和脂肪酸辅酶A通过酰基辅酶A脱氢酶、烯酰辅酶A水合酶、羟基酰基辅酶A脱氢酶和3-酮酰基辅酶A硫解酶组合进行氧化,这些过程构成β-氧化。不饱和脂肪酸辅酶的双键必须通过Δ3, Δ2-烯基-辅酶A异构酶(ECI)和2,4-二烯基-辅酶A还原酶1 (DECR1)等辅助途径去除,才能进入β-氧化。这些反应产生用于三羧酸循环的乙酰辅酶A以及为电子传递链提供燃料的FADH2和NADH。
二、肿瘤脂质和脂肪酸代谢途径
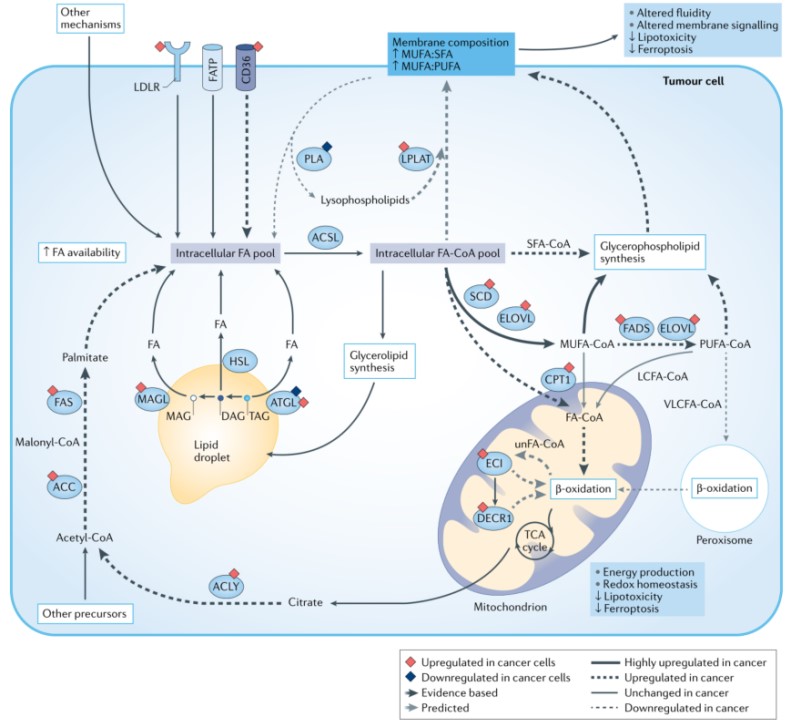
癌细胞细胞膜特征是单不饱和脂肪酸酰基(MUFA)侧链与饱和脂肪酸酰基(SFA)侧链比例以及MUFA与多不饱和脂肪酸酰基(PUFA)侧链比值增加,从而降低脂毒性和对铁死亡的敏感性。这些特征是通过一系列机制,包括LDL受体(LDLR)、脂肪酸转运蛋白(FATP)和CD36以及其他促进细胞内脂肪酸库的机制,从血流和微环境中增加摄取细胞外FAs的结果。肿瘤细胞也会通过乙酰辅酶A羧化酶(ACC)和脂肪酸合酶(FAS)利用一系列非脂质底物产生棕榈酸酯增加脂肪酸从头合成。细胞内FAs可通过脂肪三酰甘油脂肪酶(ATGL)、激素敏感脂肪酶(HSL)和单酰甘油脂肪酶(MAGL)催化脂滴脂解和脂吞噬从而被动员。游离FAs也通过甘油磷脂经磷脂酶As和Bs生成溶血磷脂进而水解而释放。FAs通过长链酰基CoA合成酶(ACSL)转化为脂肪酸酰基CoAs (FA-CoAs)而被激活。FA-CoAs可以通过硬脂酰CoA去饱和酶(SCD)或FA去饱和酶(FADS)作用而去饱和,或通过极长链脂肪酸酶(ELOVLs)而延长,从而增加MUFA-CoAs。这些FA-CoAs可用于脂滴中甘油脂合成和甘油磷脂合成或通过溶血磷脂酰转移酶(LPLAT)酰化溶血磷脂合成甘油磷脂以维持细胞膜稳态。
FA-CoAs可被线粒体和过氧化物酶体氧化。VLCFA-CoAs通过过氧化物酶体氧化产生底物供线粒体氧化。LCFA- CoAs通过CPT1转运到线粒体,而短链和中链FA-CoAs则被动运输穿过细胞膜。饱和FA-CoAs直接进入β-氧化,而不饱和FA-CoAs (unfA -CoAs)的双键在进入β-氧化之前,通过ECI和DECR1等途径被去除。这些反应为电子传递链(ETC)提供燃料。总的来说,过氧化物酶体β-氧化在癌细胞中降低可能是由于极长链PUFA-CoAs水平降低,而长链PUFA-CoA β-氧化增加导致PUFAs相比于MUFAs水平降低。
三、治疗抵抗中脂肪酸代谢
肿瘤脂质组概念反映了从癌细胞行为到瘤外环境的变化,包括治疗耐受的癌细胞,因为它们迅速适应以提高生存和转移。重要的是,一系列癌症治疗的耐药性与肿瘤细胞脂肪酸代谢变化有关。
化学疗法
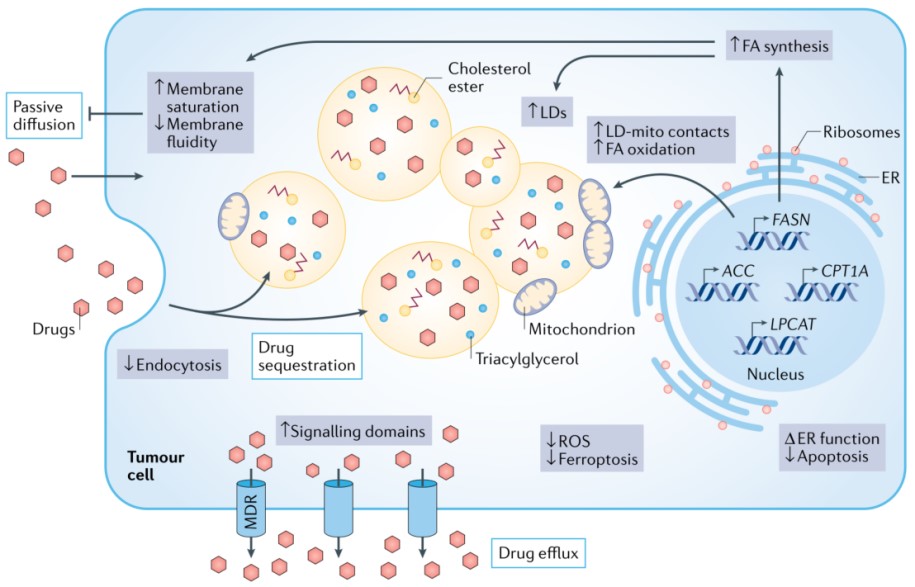
长期以来,肿瘤细胞对化疗药物的响应和耐药性一直与细胞膜脂质组成改变有关。然而,将肿瘤脂质代谢与耐药联系起来的临床数据尚不充足。根据现有临床前数据,耐药癌细胞株特征之一是膜脂质双分子层流动性降低。由于流动性降低,通过被动扩散和/或内吞作用的药物摄取可能会中断。此外,它还能增强抗去垢剂膜结构域的形成,从而激活膜结合ATP结合盒(ABC)多药外排转运体,如ATP依赖转位酶(也称为p糖蛋白;ABCB1),从而导致多药耐药表型,影响化疗以外其他抗癌药物药效。有趣的是,膜流动性的药理学调节(如补充多不饱和脂肪酸)可以改变ABCB1介导的药物外排,表明临床脂质修饰剂或饮食干预可能是一种有前途的化学增敏策略。
脂滴积累是化疗耐药肿瘤细胞株的另一个特征,但其研究较少。有趣的是,triacsin C(一种长链脂肪酰基辅酶A合成酶(ACSL)抑制剂)可以抑制脂肪酸激活,进而阻止脂滴生成。triacsin C可以增加体外和小鼠移植结直肠癌化疗敏感性。脂滴在营养胁迫条件下作为脂肪酸氧化的额外脂质来源,或作为隔离疏水性药物的“库”,可直接促进化疗耐药。
放射治疗
抗放射治疗的肿瘤细胞系通常具有脂肪酸氧化程度及CPT1A表达同时增加的特点,类似于化疗耐药。在肺癌细胞中发现,与单一放疗相比,放疗联合使用依托莫西可进一步降低脂滴数量和大小。临床上抗放射治疗中脂肪酸氧化和CPT1A表达增加可用肿瘤CPT1A表达水平较高的鼻咽癌患者放疗后总生存期较低所佐证。在头颈部鳞状细胞癌同基因细胞系中,已经报道除脂肪酸氧化外的其他代谢过程也有助于放射抵抗产生。与敏感细胞相比,抗放射细胞表现出脂肪酸摄取减少和葡萄糖摄取增强。这些抗放射细胞FAS表达升高导致葡萄糖合成脂肪酸和内源性脂肪酸氧化增加。
靶向治疗
生物靶向治疗:研究发现HER2信号激活FAS的表达和/或活性以驱动肿瘤细胞增殖,并且这些途径之间存在双向调控。FAS抑制被认为是抑制临床前肿瘤模型HER2靶向治疗曲妥珠单抗或拉帕替尼获得性耐药的合理策略。与化疗耐药性类似,通过药物抑制PI3K途径存活的癌细胞中脂滴大小、数量、脂肪酸氧化均增加,维持了细胞存活和肿瘤生长。HER2靶向治疗后,乳腺癌组织CD36被明显诱导,CD36水平较高的肿瘤患者临床预后较差,表明脂肪酸摄取和代谢参与耐药产生。
脂肪酸氧化也是热休克蛋白90 (HSP90)靶向抑制的一种适应性生存途径。临床上luminespib与脂肪酸氧化抑制剂哌克昔林联合治疗,可协同降低前列腺癌细胞系的生存能力,并对患者来源的肿瘤外植体具有显著疗效。有趣的是,这种组合可能通过调节肿瘤内活性氧水平来减弱热休克反应(一种已知的耐药介质)。
内分泌靶向治疗:与它们的合成代谢作用一致,雌激素和雄激素等性激素对其靶组织以及激素依赖性乳腺癌和前列腺癌中的脂质代谢产生深远影响。内分泌疗法(针对性激素产生或作用)在治疗局部复发或转移性疾病中反映出乳腺癌和前列腺癌细胞对激素信号通路的生存依赖性。然而,产生抗药性也是常见的。在乳腺癌和前列腺癌体外和小鼠模型研究中,脂质调控剂(如CPT1或FAS抑制剂)与内分泌疗法联合研究显示出很好的应用前景,但这些结果缺乏临床支持,特别是乳腺癌。
四、肥胖与肿瘤进展
对于治疗中发生的关键代谢转换、此类转换事件的可塑性以及在更复杂的微环境中肿瘤异质性的代谢影响,仍需要详细的机制进行解释。比如肥胖对肿瘤的影响,据报道肥胖患者的癌症进展存在改变,包括治疗耐药性的发展。这种情况下,肿瘤脂肪酸代谢适应“宏观层面”的宿主属性,并在局部微环境层面影响疾病行为。
宿主生理学
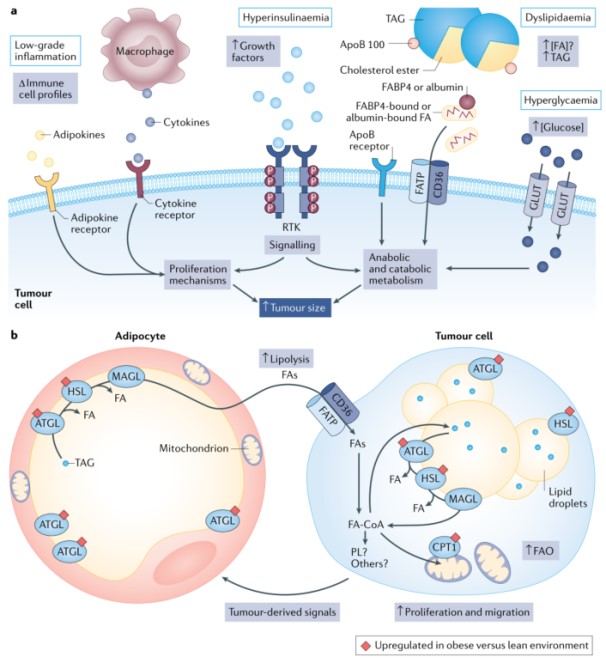
肥胖人群中许多癌症的风险和与癌症相关的死亡率发生改变,这一结论得到一系列临床前癌症模型的数据支持。不过,肥胖患者癌症生存率降低相关机制尚不明确,但已提出包括高胰岛素血症、低度炎症、脂肪因子水平改变、高血糖和血脂异常等观点。然而,缺乏证据表明这些机制中的任何一种都是肥胖患者可行的治疗靶点。
最近一项研究报告肿瘤微环境脂肪酸水平受癌细胞脂肪酸代谢影响,从而改变CD8+ T细胞的活性。肿瘤细胞和微环境中免疫细胞对脂肪酸可用性和竞争维持肿瘤的生长,然而,与循环脂肪酸缺乏联系。肥胖中游离脂肪酸可用性是复杂的,研究一致报道,肥胖患者血浆游离脂肪酸总水平没有增加,且与BMI无关。肥胖患者癌细胞可用脂肪酸增加来自于含脂蛋白的TAGs,而不是来自于脂肪衍生的游离脂肪酸。肥胖患者癌症存活率降低的假设机制(包括脂肪酸的可获得性,假设胖是一种同质环境)包括高胰岛素血症、低度炎症、脂肪因子水平改变、高血糖和血脂异常。可以肯定的是肿瘤行为受到宿主生理严重影响,因此,肥胖对全身代谢驱动和物质可用性具有很大影响。
脂肪-肿瘤相互作用
肥胖和肿瘤生物学改变之间常见机制是局部(基质)脂肪细胞和癌细胞之间的相互作用。在疾病不同阶段,许多肿瘤组织与脂肪组织共存。脂肪细胞是脂肪组织中最主要的细胞类型,与肿瘤-脂肪细胞界面远端的脂肪细胞相比,那些紧密定位于肿瘤附近的脂肪细胞更小。这表明肿瘤清除了附近的脂肪细胞,已有体外研究证明脂肪细胞衍生的脂肪酸确实在癌细胞中积累。
肿瘤会影响肿瘤周围脂肪细胞导致表型改变(癌症相关脂肪细胞)。体内环境受局部和全身信号(包括肿瘤相关信号)的影响,导致前列腺周围脂肪组织的脂质通量和其他脂质属性发生改变。在体外,脂肪细胞可以影响癌细胞行为。许多脂肪细胞衍生的因子已被报道介导这些效应,包括脂肪因子、脂肪细胞因子、激素、蛋白酶和脂质。本研究证明,脂肪细胞脂解对于脂肪细胞介导的乳腺癌细胞增殖效应是必需的。脂肪细胞衍生脂肪酸在癌细胞中积累是由于脂肪酸摄取相关蛋白水平的增加所促进,这些蛋白是脂肪细胞促生长效应所必需的。脂肪细胞衍生的脂肪酸可以作为底物在癌细胞中合成和储存脂质。
脂肪细胞对癌细胞的促生长和迁移作用涉及线粒体脂肪酸氧化。脂肪细胞刺激多种癌细胞中长链脂肪酸氧化,与CPT1A 4或CPT1B蛋白水平增加有关。虽然有越来越多的证据表明脂肪细胞在肿瘤微环境中是活跃的参与者,但许多研究需要剥夺/添加脂肪细胞的体外实验中探索这种关系。肥胖脂肪细胞的脂肪酸代谢是否会改变癌细胞生物学,而不同于瘦型脂肪细胞所观察到的结果。已有研究证明,与瘦型脂肪细胞培养的癌细胞相比,肥胖脂肪细胞培养(体外模型或来自高脂肪饮食肥胖小鼠脂肪组织)可以促进癌细胞脂肪酸氧化、脂质储存、细胞增殖和迁移。通过靶向患者生理特点,包括改变脂肪组织生长因子和激素信号,可能对癌症控制包括肥胖刺激的癌症进展进行有效干预。
肥胖和治疗抵抗
肥胖与一系列癌症治疗的临床生存率较差有关。从机制上讲,这种联系可能是多因素的,一些差异与肥胖对药物动力学和代谢的系统性影响、由于健康状况较差而减少剂量、或由于体重增加而缺乏剂量调整等有关。此外,许多药物在脂肪细胞中被隔离和代谢,增加的脂肪细胞大小和缺氧会减少血液流动性并导致炎症加剧,从而可能限制高脂肪患者药物暴露的有效水平。然而,药物可用性和剂量因素不能完全解释肥胖治疗耐药性。
越来越多的证据表明脂肪细胞驱动的机制与获得性治疗抵抗有关。癌细胞刺激脂肪细胞脂解和脂肪酸转移到癌细胞,脂肪细胞刺激癌细胞脂肪酸摄取和氧化,以及治疗抵抗细胞的脂肪酸代谢特征,包括脂肪酸氧化增加、脂滴扩张和膜成分变化,这些特征表明在肥胖环境下,癌细胞脂肪酸代谢驱动治疗抵抗。重要的是,脂肪细胞促进治疗抵抗的作用在肥胖供者脂肪细胞中更明显。饮食诱导的乳腺癌肥胖模型进一步支持了这一观点,该模型肿瘤细胞脂肪生成和脂肪分解增强,增加对阿霉素的耐药性。因此,可以想象,在脂质丰富的肥胖环境中肿瘤脂肪酸代谢活动增强可能在肥胖诱导的治疗抵抗中发挥了核心作用。
五、小结
近年来,人们越来越认识到脂肪酸代谢对肿瘤进展的深刻影响,包括维持氧化还原应激中脂肪酸稳态,从而防止铁死亡以及影响膜流动性和渗透性以促进运动和转移。脂肪酸代谢的许多变化也与获得性治疗抵抗有关,包括与肥胖相关的耐药性,并可能阐释肥胖患者中癌细胞行为变化。最近许多靶向脂肪酸代谢以克服治疗抵抗的研究指出,在肥胖和代谢功能障碍的情况下,靶向策略联合可能是未来一种可行方法。此外,如果协同靶向策略在临床实践中得到有效应用,在这些研究中使用更复杂的三维和患者衍生模型系统和临床标本是至关重要的。最后,本研究认为,可将肿瘤基因组分类与环境因素(包括饮食和全身代谢)结合起来,进而改善患者预后,设计更全面的精准医疗策略。
六、绘谱帮你测
肿瘤脂肪酸代谢的重要性越来越受到关注,本研究阐述了与治疗抵抗相关的细胞脂肪酸代谢变化,以及肥胖相关宿主脂肪酸代谢变化对癌细胞行为改变的影响。通过检测游离脂肪酸和脂质来表征机体的脂质代谢,对探索疾病的发病机理、疾病诊断和治疗干预具有重要意义。麦特绘谱拥有成熟的基于LC-MS/MS的定性和定量平台能够检测多种生物样本中多种游离脂肪酸。其中Q600、Q300全定量代谢组、宏代谢组等方法可包含60+种脂肪酸,详情欢迎咨询麦特绘谱热线400-867-2686。
参考文献
Andrew J. Hoy, et al. Tumour fatty acid metabolism in the context of therapy resistance and obesity. Nat Rev Cancer. 2021. doi: 10.1038/s41568-021-00388-4.
原文下载,请长按识别下方二维码

精彩推荐
2. Physiol Rev | 脂肪酸在健康与疾病中的作用(上)
3. Physiol Rev | 脂肪酸受体在健康与疾病中的作用(下)
4. Nature Communications | 17项前瞻性研究揭示血液高水平n-3脂肪酸与低死亡风险相关
5. Circulation | 短链脂肪酸--丙酸盐预防高血压心血管损害
6. 绘谱学堂 | 肠道菌群参与瘦型糖尿病胰岛素分泌和糖稳态调节新机制


